出口关注:医疗器械国外准入要求,下面跟着瀚而普出口外贸代理小编一起来看看吧!更多出口外贸代理欢迎来电咨询瀚而普上海外贸进出口公司,服务热线:021-35383360
医疗器械
医疗器械是与人类生命健康息息相关的产品,世界各国对医疗器械行业的发展高度重视。近年来随着我国经济发展“供给侧改革”战略的实施,将医疗器械产业的发展列入了国家发展战略中,医疗器械行业进入高速发展期,逐渐跻身国际医疗器械行业,从消费大国逐渐转化为制造大国和出口大国。
随着全球公众健康意识增强,医疗服务机构对高品质医疗器械的要求不断提高,各国政府为提升医疗器械的安全性制定了相应的法律法规,以保护民众的生命安全。
因此我国医疗器械行业在走出国门时有必要对相关国家的法律法规有所了解,并知晓相应的监管要求和市场需求的方向,针对性地采取相应的策略和措施,稳步推进,不断提高产品的能级,逐步扩大海外市场。本期小编整理了中国主要出口国家和地区医疗器械的准入要求,供大家参考。
1、医疗器械定义
医疗器械是指直接或者间接用于人体的仪器、设备、器具、体外诊断试剂及校准物、材料以及其他类似或者相关的物品,包括所需要的计算机软件。
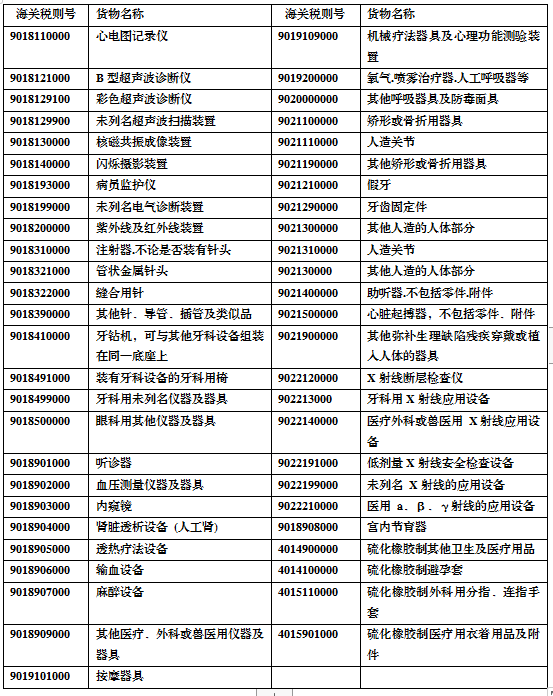
2.常见医疗器械产品海关税则号与名称
3、主要国家和地区分类及要求
美国FDA

美国食品药品监督管理局(简称:FDA),其职责是确保美国本国生产或进口的食品、化妆品、药物、生物制剂、医疗设备和放射产品等的安全,同时也负责执行公共卫生条件及州际旅行和运输的检查、对于诸多产品中可能存在的疾病的控制等。
分类
医疗器械范围很广,小到医用手套,大至心脏起博器,均在FDA监督之下,根据医疗用途和对人体可能的伤害,FDA将医疗器械分为Ⅰ、Ⅱ、Ⅲ类,等级越高监督越严。
第一类(低至中度风险):普通管理。是指风险小或无风险的产品。
第二类(中度至高度风险):普通+特殊管理。其管理是在“普通管理”的基础上,还要通过实施标准管理或特殊管理,以保证质量和安全有效性。
第三类(高风险):上市前批准管理(PMA)。是指具有较高风险或危害性,或是支持或维护生命的产品,例如人工心脏瓣膜、心脏起搏器、人工晶体、人工血管等。
准入要求
对Ⅰ类产品,企业向FDA递交相关资料并审核通过后,FDA只进行公告,但并无相关证件发给企业;
对Ⅱ、Ⅲ类器械,企业须递交PMN或PMA,FDA在公告的同时,会给企业以正式的市场准入批准函件(Clearance),即允许企业以自己的名义在美国医疗器械市场上直接销售其产品。至于申请过程中是否到企业进行现场GMP考核,则由FDA根据产品风险等级、管理要求和市场反馈等综合因素决定。
欧盟CE
欧盟为规范其市场,统一产品标准和规范,规定在欧盟市场“CE”标志属强制性认证标志,不论是欧盟内部企业还是其他国家生产的产品,要想在欧盟市场上自由流通,就必须加贴“CE”标志,以表明产品符合欧盟《技术协调与标准化新方法》指令的基本要求。这是欧盟法律对产品提出的一种强制性要求,出口到欧盟的医疗器械没有CE认证无法清关。

欧盟CE 认证标志
分类
根据欧盟新颁布的医疗器械法规《医疗器械法规》(2017/745,MDR)和《体外诊断器械法规》(2017/746,IVDR),现在欧盟范围内医疗器械只分两类:医疗器械MD和体外诊断器械IVD。
根据申明的产品预期使用目的,如果产品是侵入式的或接触到皮肤的,则属于MDR管辖的医疗器械MD;如果是非侵入式的或完全接触不到皮肤的,则属于IVDR管辖的体外诊断器械IVD。
根据《医疗器械法规》(MDR),医疗器械MD根据风险等级分为 I、IIa、 IIb、III类。
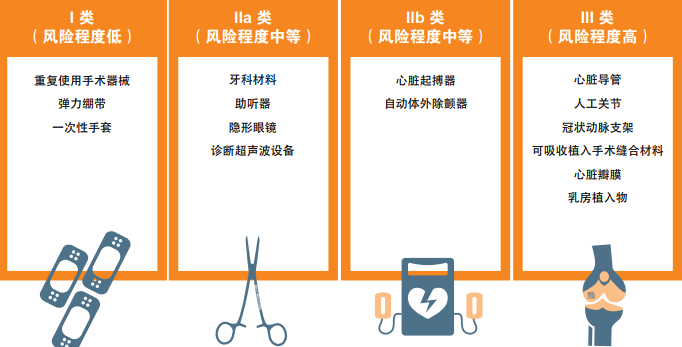
而根据《体外诊断器械法规》(IVDR),体外诊断器械IVD依据风险等级由低到高分为A、B、C、D四类。
新规主要变化
一是在法规层级上将指令上升为法规;
二是该两个医疗器械法规取代了之前的三个医疗器械指令;
三是体外诊断器械分类规则变化较大。
2017年欧盟颁布的两个新法规2017年生效,但有一定过渡期,分别于2021年5月和2022年5月强制实施。
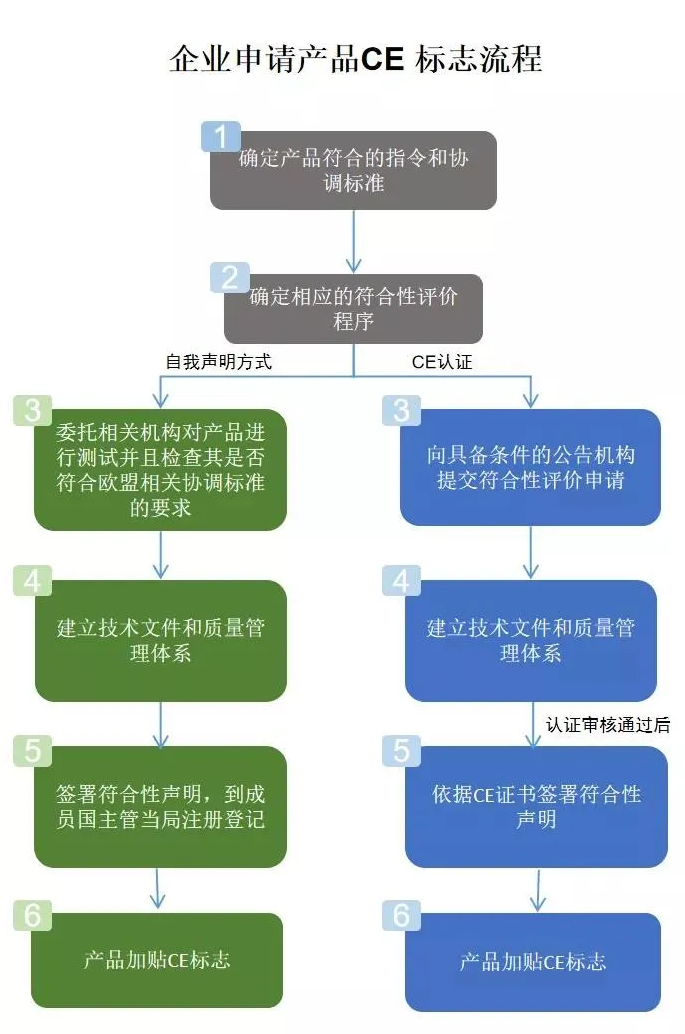
CE认证流程
澳大利亚TGA
澳大利亚药品管理局(TGA),是澳洲医疗用品的监管机构,负责一系列评估和监管确保澳洲药品保质保量。TGA监管的产品范围包括药品,医疗器械,血液及血液产品。
分类
澳大利亚将医疗器械根据其构成的风险程度分为五大类。分类级别越高,要求就越苛刻。
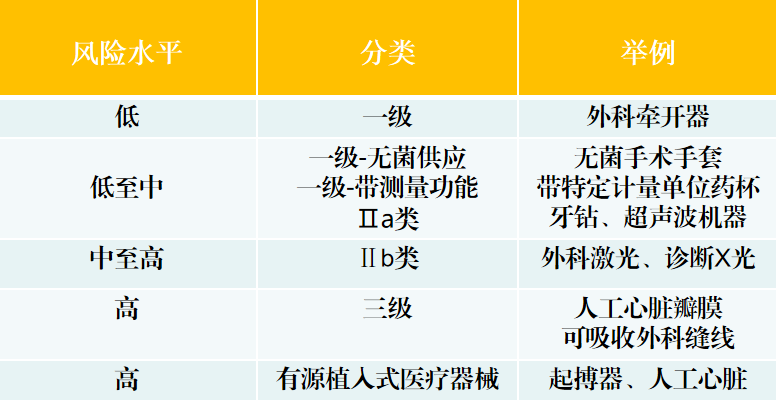
准入程序
一、如果医疗器械是在海外制造的(即I类消毒; I类测量; IIa类; IIb类,III类,AIMD类)
1. 制造商从TGA或欧盟的认证机构获得合格评定证据;
2. 制造商准备澳大利亚符合性声明;
3. 主办者向TGA提交制造商的证据;
4. 主办者递交在ARTG登记申请;
5. 在ARTG登记后主办者可以在澳大利亚供应器械;
6. 器械上市后持续监控。
二、如果该器械包含一种药物或动物材料,微生物或人类起源物(即 III类和 AIMD类):
1. 制造商决定质量规程,用于证示器械符合相关的基本原则,并准备必要的文件;
2. 制造商申请TGA合格评定证;
3. 制造商准备澳大利亚符合性声明;
4. 主办者向TGA提交制造商的证据;
5. 主办者递交在ARTG登记申请;
6. 在ARTG登记后主办者可以在澳大利亚供应器械;
7. 器械上市后持续监视。
加拿大CMDCAS
加拿大医疗器械准入认证为CMDCAS认证,由卫生部发布,加拿大实行政府注册结合第三方的质量体系审查。这里所说的第三方,指经加拿大医疗器械认证认可机构(CMDCAS)认可的第三方机构。
分类
依据CMDR(加拿大医疗设备管理条例 ) SOR/98-282,根据器械的使用风险将医疗器械分为I、 II、III、IV四个分类,如I类器械为最低风险,IV类器械风险为最高。为此针对制造者提出的产品注册要求也是逐级增加,要求制造者实行的体系是愈加详尽。
注册流程
Class I:
1、为申请 MDEL(加拿大医疗器械营业许可证)准备相应的技术文件;
2、提交MDEL申请,支付卫生部行政收费;
3、申请评审通过,将在Health Canada网站公示。
Class II、III、IV:
1、通过CMDCAS认可的认证机构进行ISO 13485 审核认证(体系审核除ISO13485要求外还要包括CMDR的特殊要求),获得证书;
2、准备MDL(加拿大医疗器械许可证)申请;
3、提交MDL申请,并交纳卫生部行政收费;
4、Health Canada评审MDL申请, 评审通过后进行网站公示。
此外,加拿大对III、IV类医疗器械还需审核Premarket review documents(上市前审查文件)。
韩国KFDA
韩国卫生福利部,简称卫生部,主要负责管食品、药品、化妆品和医疗器械的管理,是最主要的卫生保健部门。
依照《医疗器械法》,韩国卫生福利部下属的食品药品安全部负责对医疗器械的监管工作。
韩国医疗器械法把医疗器械分为4类(Ⅰ、Ⅱ、Ⅲ、Ⅳ),从Ⅰ类至Ⅳ类风险程度递增,即:Ⅰ类为几乎没有潜在危险的医疗器械,Ⅳ类为高风险的医疗器械。
分类
Ⅰ类:几乎没有潜在危险的医疗器械;
Ⅱ类:具有低潜在危险的医疗器械;
Ⅲ类:具有中度潜在危险的医疗器械;
Ⅳ类:高风险的医疗器械。
注册流程
1、确定产品分类(I、II、III、IV),选择韩代KLH(韩国证书持证人,不在韩国境内的企业需要选择一个韩国证书持证人,通常为在韩国的分销商);
2、II类产品需申请KGMP证书和接受现场审核,II类产品一般是授权的第三方审核员,并获得KGMP证书;
3、II类产品需要送样品到韩国MFDS授权的实验室进行韩国标准的测试;
4、由韩代向MFDS提交技术文件(检测报告,KGMP证书等),进行注册审批;
5、支付申请费用;
6、注册文件整改,注册批准;
7、指定韩国代理商和经销商,产品销售。
上海瀚而普国际贸易有限公司是一家以进口外贸代理、出口外贸代理及自营各类商品和技术的进出口业务、国际供应链业务为主的专业化、多功能、综合性的进口外贸代理公司,我公司也提供预归类和产地证服务,24小时应急响应,提供出口外贸代理、清关等一揽子进出口服务,出口外贸代理热线:021-35383360。
转自网络,如侵删。







 关注瀚而普微信号
关注瀚而普微信号