技术性贸易措施指南-防护服出口篇(上),下面跟着瀚而普出口外贸代理小编一起来看看吧!更多出口外贸代理欢迎来电咨询瀚而普上海外贸进出口公司,服务热线:021-35383360
为全面贯彻习近平总书记关于统筹做好新型冠状病毒肺炎疫情防控和经济社会发展工作重要指示精神,落实海关总署支持外贸企业复工复产,促外贸稳增长10项措施,结合国内外新冠肺炎疫情防控形势、国内防护物资产能过剩、外贸企业频繁咨询防护物资出口政策等因素,为促进外贸企业复工复产、有效消化国内富余产能和富余物资,促外贸稳增长,现就物资出口通关要求及收集整理的防护服类防控物资国外主要技术性贸易措施提示如下:
一商品归类:
除特殊情况外,绝大部分防护服按照材质分类应归入下列税号:
商品 材质 商品税号
医用防护服 化学纤维 62101030
橡胶 40159010
塑料 39262090
二禁限管理:
目前商务部未对防护服设置贸易管制要求,中国海关也无针对防护服物资的监管证件口岸验核要求。
三出口退税:
防护服的出口退税率为13%。
四原产地优惠:
中国已经和25个国家或地区签署了17个自由贸易协定,中国原产的商品,包括疫情防控物资,出口到这些国家和地区凭优惠原产地证书可以获得关税减免优惠。
以出口防护服到韩国为例,可以看到关税减免的幅度是很大的,所以建议出口前向海关申请原产地证书。
HS编码 优惠税率 最惠国税率
(8位)(凭中韩原产地证书适用)(如没有中韩原产地证书)
39262090 2.6% 6.5%
40159010 3.2% 8.0%
62101030 5.2% 13.0%
疫情防控需要的防护服出口涉及的公司资质证明材料与出口口罩基本相同,可参见《促外贸稳增长-海关技术性贸易措施指南(口罩出口篇)》
五产品准入条件:
美国
必须要取得美国食品和药物管理局FDA注册认证才可以在美国本土市场进行销售。

防护服分类:
美国医用防护服可分为非手术防护服和手术用防护服两类。非手术防护服属于I类医疗器械,免于上市前登记,直接进行机构注册。而手术用防护服属于II类医疗器械,需要进行上市前登记,即需要申请FDA 510(K)。I类和II类医用防护服的判断依据见下表。
医用防护服分类及判断依据
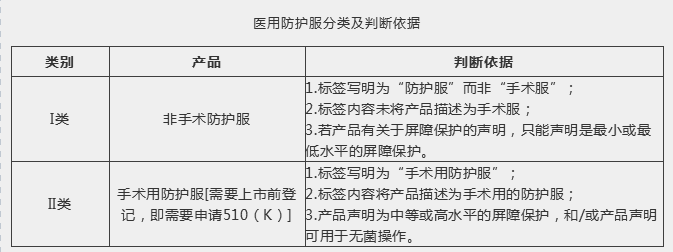
2004年,FDA认可了美国国家标准学会/美国医疗器械促进协会标准ANSI/AAMI PB70《医疗保健设施中使用的防护服和防护布的液体阻挡层性能和分类》。企业申请上市前登记,一般都需要根据ANSI/AAMI PB70对防护服进行性能测试。
欧盟
须获得欧盟CE认证,并符合技术法规:(EU)2016/425
2016年3月9日,欧盟通过了个人防护装备(PPE)法规(EU) 2016/425,该法规撤销并替代了PPE指令89/686/EEC,于2018年4月21日正式实施,并指出2019年4月21日之后投放市场的产品必须满足(EU)2016/425中所有的要求,该法规覆盖防护服、呼吸防护设备、手套等防护产品的安全监管。此期限,出口外贸企业和生产企业须重点注意。
根据法规(EU)2016/425第8条,出口欧盟的防护服制造商需要:
● 确保其产品符合法规附件Ⅱ列出的基本健康及安全要求;
● 撰写法规附件Ⅲ所述的技术文件;
● 进行适用的合规评估程序;
● 撰写欧盟合规声明;
● 按照法规在产品贴附CE标记;
● 在个人保护装备标明制造商的名称、注册商号或注册商标、地址等;
● 确保个人保护装备附有类型、批次或序列编号,以便识别;
● 撰写使用说明,与个人防护装备一并提供。说明书必须包含制造商的名称及地址,以及可以连接到欧盟合规声明的互联网址。若欧盟合规声明是随个人防护装备附上,说明书则无需包含互联网址。
个人防护装备投放市场后10年内,制造商必须保存其技术文件及欧盟合规声明。
日本
如果需要投放市场产品必须满足日本的Pharmaceutical and Medical Device Act (PMD Act),在PMD Act的要求下,TOROKU注册系统要求国外的制造商必须向PMDA注册制造商信息。
日本的政府机构主要是制定法律法规和进行宏观管理,具体业务工作很多都交给各类行业协会来做。防护服涉及的主要行业协会为日本安全设备协会(JSAA)和日本防护服协议会(JPCA)。
● 日本安全设备协会(JSAA)网址:
http://jsaa.or.jp/
● 日本防护服协议会(JPCA)网址:
http://bougofuku.net/index.html
● 日本医药品和医疗器械综合机构(PMDA)网址:
www.pmda.go.jp
韩国
韩国医疗器械准入的法规门槛,基本分类为I、II、III、IV类,持证为韩国公司(License holder),韩国收货人需要到韩国药监局Korea Pharmaceutical Traders Association. 提前备案进口资质(没有不行)网址:www.kpta.or.kr。
2020年1月15日,韩国劳动部2020-35号公告《防护设备安全认证通知》内给出了化学物质防护服、防尘口罩等性能标准和测试方法。根据《防护设备安全认证通知》内的防护服性能标准内容,防护服共分为六大类(其中第一类又分为5小类),类别见下表:
类别(大类)
类型区分标准
1类内部或外部带有呼吸供给的一体式防护服
2类配有正压式呼吸器的一体式防护服
3类防液体防护服
4类防喷雾防护服
5类防尘防护服
6类防液体飞溅的防护服
《防护设备安全认证通知》全文可在
http://www.law.go.kr/%ED%96%89%EC%A0%95%EA%B7%9C%EC%B9%99/%EB%B3%B4%ED%98%B8%EA%B5%AC%EC%95%88%EC%A0%84%EC%9D%B8%EC%A6%9D%EA%B3%A0%EC%8B%9C下载
澳大利亚
须通过澳洲的TGA注册,TGA 是Therapeutic Goods Administration的简写,全称是治疗商品管理局。澳大利亚对医疗器械分为I类,Is and Im, IIa, IIb, III类,分别为豁免、备案和注册。无论哪类医疗器械,其上市销售前必须得到澳大利亚政府的准许,符合医疗器械的基本要求,按照符合性审查程序进行审查。
特别提醒:澳大利亚已与欧盟达成互认协议。这意味着,合格评定证书由TGA颁发的也被欧盟认可,TGA也认可欧盟CE认证。已获CE认证的用户,可提交CE证书及相关资料,获得TGA证书。
如果产品已经注册或备案,制造商更换经销商对其没有影响。对国外产品进行注册审批后,每年还要常规注册一次,说明产品型号、性能及质量有无变化。TGA 全权负责对医疗器械的符合性评价,并收取一定费用,相关费用金额可参见 TGA的网站。
● 澳大利亚治疗商品管理局(TGA)官网网址:
www.tga.gov.au
● 2002年《医疗器械法规》下载链接:
https://www.legislation.gov.au/Series/F2002B00237
出口日本、韩国、澳大利亚医用防护服注册、认证流程与医用口罩相同,具体流程可参见《促外贸稳增长-海关技术性贸易措施指南(口罩出口篇)》
上海瀚而普国际贸易有限公司是一家以进口外贸代理、出口外贸代理及自营各类商品和技术的进出口业务、国际供应链业务为主的专业化、多功能、综合性的出口外贸代理公司,24小时应急响应,提供出口外贸代理、清关等一揽子进出口服务,出口外贸代理热线:021-35383360。
转自网络,如侵删。







 关注瀚而普微信号
关注瀚而普微信号